研究内容
研究目的
本研究の目的は、臓器線維化のキープレイヤーである筋線維芽細胞の運動機能に着目し、筋線維芽細胞への分化機構と収縮制御の細胞内情報伝達系を明らかにすることによって、収縮系の人為的制御で臓器線維症が治療できるかどうかの可能性を探ることにある。
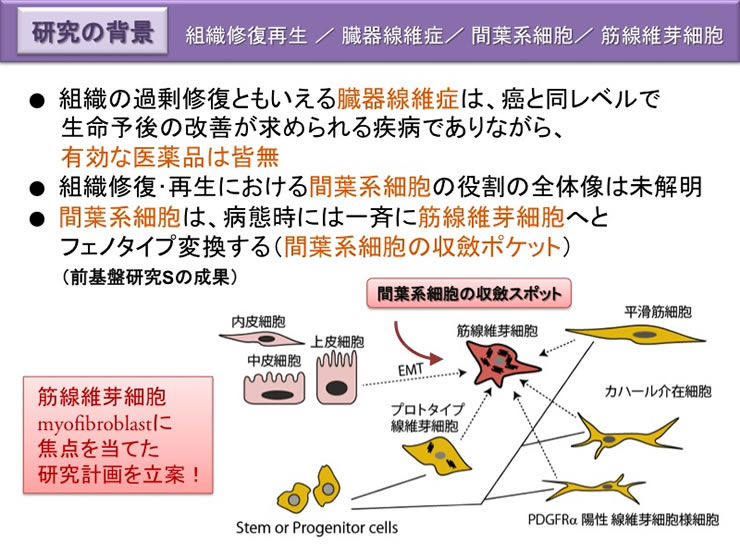
実質臓器(肝,心,肺,腎,消化管など)にみられる線維症は、放置すればいずれも死の機転をとる重篤な慢性疾患である。癌と同レベルで生命予後の改善が求められる疾病でありながら、研究は著しく立ち遅れ、有効な医薬品は皆無である。これまでの臓器線維化に関する研究は、組織増殖因子TGFβの作用を中心に、免疫機能とコラーゲン産生能の獲得という点に注がれてきた。基盤研究Sで複数機関による統合研究として実施することにより、病態時に三次元に躍動する間葉系細胞の姿が再認識され、収縮機能という別次元からの臓器線維症治療戦略を提示できる。
① 研究の学術的背景
上皮系細胞は臓器の内面や外面の表層に二次元に整然と並び、秩序正しい動きをするので注目されやすいが、線維芽細胞などの間葉系細胞は、単に間質をうめる要素と考えられ(間充織)、あまり表舞台にでることはなかった。しかし最近の研究で、これらの間葉系細胞は置かれた状況によってダイナミックに機能分化して特異的な臓器機能調節機能を持つこと、さらに病態時には、炎症や免疫機能を発揮して生体防御の中心的な機能を示すことが次第に明らかになりつつある。
1) 臓器線維症と筋線維芽細胞
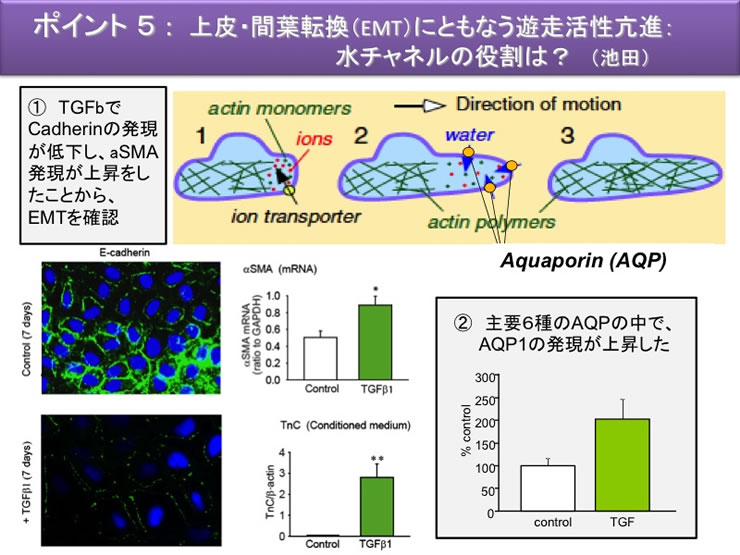
本研究で着目する病態は臓器線維症であり、そのキープレイヤーである「筋線維芽細胞myofibroblast」である。組織の臓器線維症は、組織修復・再生過程において活性型の筋線維芽細胞が出現し、線維素産生を過剰に亢進させる疾病と考えられている。線維芽細胞は、炎症が慢性化して障害ストレスを繰り返し受けると、線維素産生能が亢進すると同時に、運動機能を付与する平滑筋型ミオシン(αSMA)の発現を著しく亢進させることから「筋」の名が付されている。この様な活性化型筋線維芽細胞への分化には、傷害部位へいち早く遊走して傷口を線維素で覆うという意義と、傷害部位で収縮(創収縮)して傷口の面積を最小限にするという2つの意義がある。
2) 筋線維芽細胞の起源
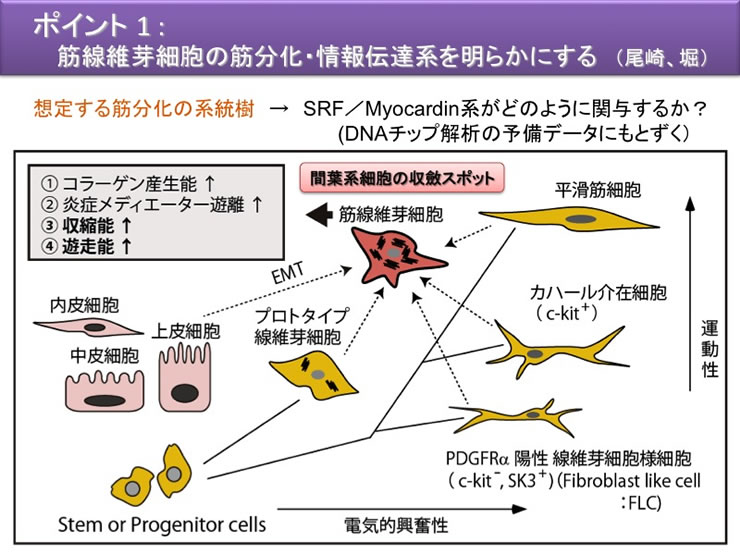
通常の線維芽細胞は間質に無秩序に多数存在するのに対して、筋線維芽細胞は、正常状態で肝、肺、皮膚、腎、消化管粘膜などの各種の臓器に特異な細胞形態(星型)で存在している。肝星細胞(伊東細胞)、膵星細胞、メサンギウム細胞などと固有の名前がつけられているものもある。筋線維芽細胞は、障害ストレスによってαSMA の発現を増加させると同時に、細胞外マトリックスや各種サイトカインの発現も増加させ、細胞形状も変えて活性化型筋線維芽細胞へと変貌する。活性化型の筋線維芽細胞のソースは、間葉系細胞にとどまらない。臓器管腔の内面を覆う上皮系細胞が間葉系の筋線維芽細胞へと分化する経路(上皮・間葉転換EMT)もある。
このように、筋線維芽細胞の起源は多様であり、上皮系細胞もそのソースとなり得る。組織傷害部位において様々な起源の細胞が筋線維芽細胞へ収斂するという現象から、「非常時には全ての間質細胞を総動員して傷害部位を修復する」という姿が見えてくる。申請者は、これを間葉系細胞の収斂ポケットと呼ぶことを提唱した(平成19〜24 年度基盤研究S の成果)。
3) 筋線維芽細胞研究の現状と問題点
最近、筋線維芽細胞に関する研究論文は増加し続けている。その大部分は、組織増殖因子
同時に応募している基盤研究(A)との違いは、① 【項目8】「ヒト臨床からのアプローチ」を追加した点、② 【項目5,6,7,8】を連携研究者ではなく研究分担者とした点、③ 3 機関が3 名のポスドク(プラス1 名の技術補佐員)を雇用し研究に格段の厚みを持たせた点である。主な追記箇所を「★」で示した。
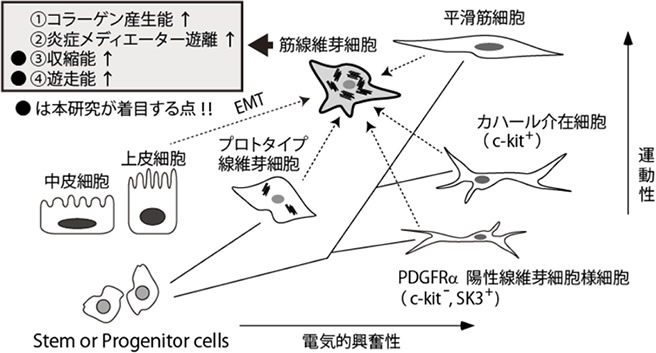
図1 間葉系細胞の分化系統樹と収斂ポケット(シェーマ図):組織障害時には、筋線維芽細胞(中央)のソースは多様である。炎症にともなう線維芽細胞の活性化だけではなく、上皮系細胞の脱分化(EMT)、間葉系細胞の平滑筋細胞やカハール介在細胞などの脱分化なども考えられる。
TGFβ-Smad 系に着目したコラーゲン産生能に関わる情報伝達系の研究、各種の炎症性サイトカインに着目した免疫機能の亢進に関する研究などに関心が向けられている。反面、筋線維芽細胞が持つ運動機能(収縮や遊走)に関する研究は極めて少ない。
本研究で着目する事象は、これまでほとんど手が付けられていない運動機能に関するものであり、収縮機能獲得機構と収縮制御の細胞内情報伝達系である。
② 研究期間内に何をどこまで明らかにしようとするのか
本研究は、腸および肝臓に分布する筋線維芽細胞へと分化する細胞群を対象として、運動機能(収縮機能ならびに遊走活性)亢進の分子機構の解明に取り組む。これら臓器に分布する様々な細胞を対象とするが、具体的には7 つの研究項目(下表)を設定して研究を進める。これらの項目に関して、腸炎モデル、肝炎モデルなどを用いたin vivo における検証と機能分子発現抑制による病態制御を探る。
表1
| 研 究 項 目 | 着目する分子群、マーカー分子 | |
|---|---|---|
| 1 | 筋線維芽細胞の筋分化機構(転写制御系の解明) | SRF/Myocardin, CPI-17,MYPT-1, RhoA, MLCK, SM22 |
| 2 | 筋線維芽細胞の収縮機能情報伝達系 | CPI-17, MYPT-1, RhoA, MLCK |
| 3 | 筋線維芽細胞のソースとしての上皮・間葉転換 | Cadherin, Cytokeratin |
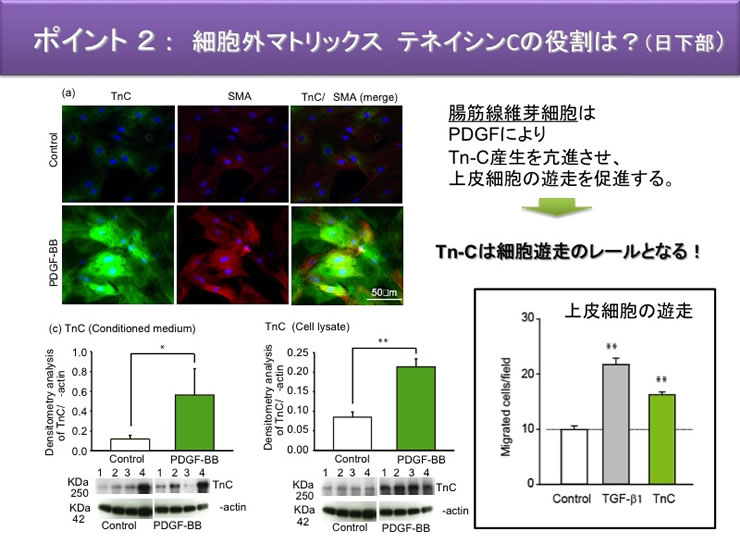
| 4 | 筋線維芽細胞が産生する細胞外マトリックスの役割 | Tenascin-C, Collagens |
| 5 | 細胞遊走時の細胞変形の分子機構(水チャネルの関与) | Aquaporins, CPI-17, MYPT-1 |
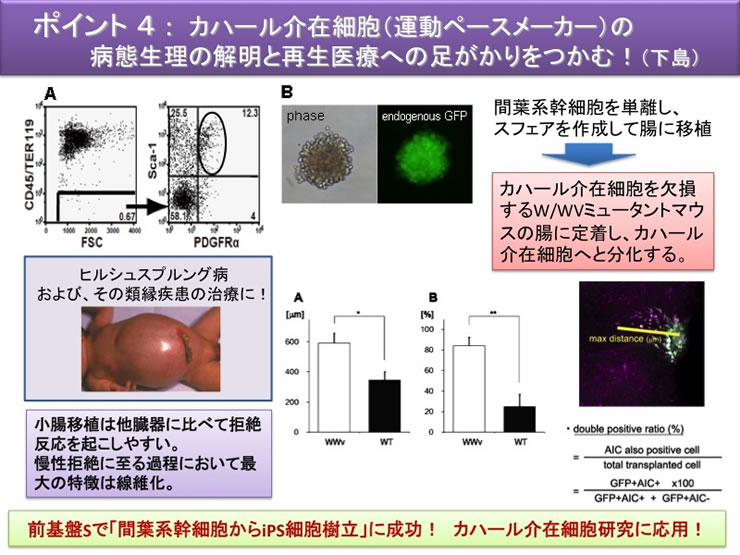
| 6 | カハール介在細胞の病態変化 | c-Kit, Contractile proteins |
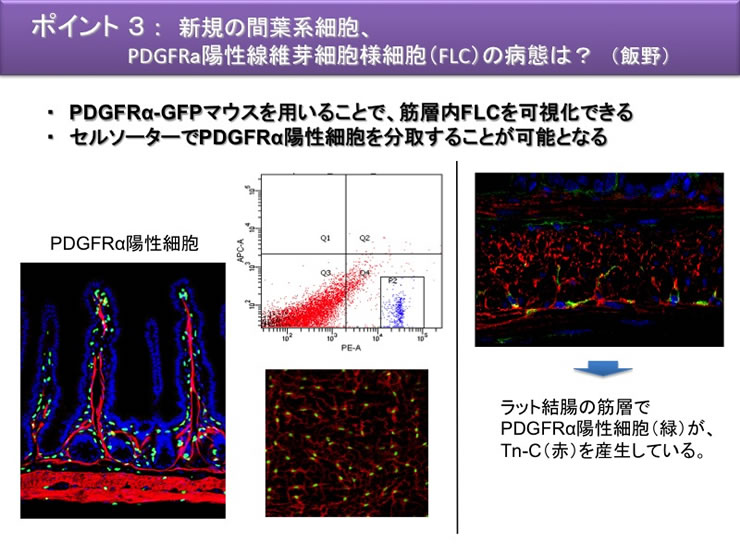
| 7 | PDGFRα陽性線維芽細胞様細胞の病態変化 | PDGFRα, SK3 |
| 8 | ヒト臨床からのアプローチ(小腸移植後の腸線維化、カハール介在細胞不全に着目した運動機能障害) | 上記の分子群 |
③ 当該分野における本研究の学術的な特色及び予想される結果と意義
1)学術的な特色
本研究は、これまで見過ごされてきた収縮能力(運動能力)や細胞遊走活性など、間質を舞台に三次元的に動き回る筋線維芽細胞の生理ならびに病態生理機構に視点をおくことに大きな特色がある。間質細胞としてのカハール介在細胞、α型PDGF 受容体(PDGFRα)陽性線維芽細胞様細胞の病態機構については全く手がつけられていない。
2)研究の意義
臓器線維症はいずれも死の機転をとる重篤な慢性疾患である。癌と同じように生命予後の改善が求められる疾病であるが、研究は著しく立ち遅れ、抗線維症薬は「治療に対する薬剤の貢献度」という点では抗癌薬に比べはるかに劣る。「動き」を制御することにより筋線維芽細胞の線維素産生という本来の機能を発揮できなくするという発想が証明されれば、臓器線維症さらには癌研究分野においても新しい創薬ターゲットとなることが期待できる。★さらに本研究では、ヒト臨床研究を加えた。小腸移植後の線維化およびヒルシュスプルング病を取り上げ、「トランスレーショナルリサーチ」に配慮した。本研究は新たな臓器線維症治療法の開発につながる可能性があり、新しい研究領域を形成できる基盤的研究である。